1.8.3 Потенциодинамический метод#
Принципиальной особенностью коррозии в растворах электролитов, как и других электрохимических процессов, является зависимость скорости процесса от потенциала металла. Полученную зависимость описывают поляризационные диаграммы.
Поляризационные диаграммы, называемые иногда диаграммами Эванса, – это графики зависимости потенциала от логарифма тока или плотности тока. Впервые они были предложены У.Р. Эвансом из Кембриджского университета (Англия), который продемонстрировал полезность таких диаграмм для предсказания коррозионного поведения металлов. Такие диаграммы получают с помощью потенциодинамического (потенциометрического) метода. Поляризационная диаграмма процесса электрохимической коррозии приведена на рисунке 16.
Потенциодинамический метод – это метод качественного и количественного анализа, основанный на измерении потенциалов, возникающих между испытуемым раствором и погруженным в него электродом.
В потенциодинамическом методе с помощью потенциостата осуществляется изменение (развертка) потенциала электрода со скоростью от 0,5 до 100 мВ/с. При изменении потенциала электрода в определенной области потенциалов происходит ионизация адсорбированного водорода, и скорость этого процесса фиксируется по изменению силы тока, возникающего в системе. В результате могут быть получены поляризационные кривые, отражающие изменение состояния адсорбированного на поверхности водорода.
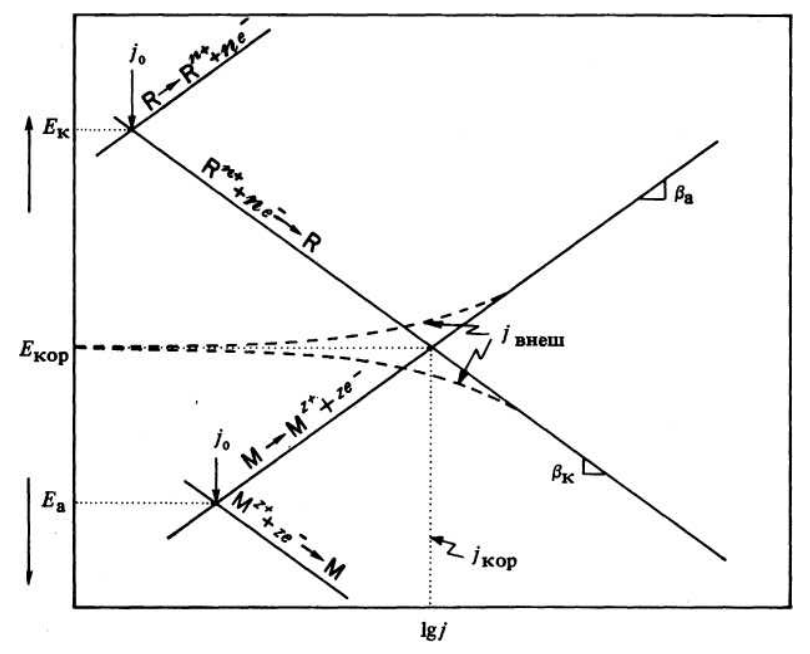
Как видно из рисунка в зависимости от величины перенапряжения имеет место линейная и нелинейная поляризация.
В области линейной поляризации ток линейно зависит от напряжения, то есть выполняется закон Ома.
Область линейной поляризации используется в коррозиметрах при мониторинге коррозии. Коррозиметры не дают абсолютных величин скорости коррозии. Это связанно с тем, что В ≠ const и изменяется в зависимости от условий.
При дальнейшем повышении потенциала, зависимость тока от потенциала становится нелинейной. Нелинейная область называется тафелевской областью. Известно, что коррозионный процесс подчиняется основным закономерностям электрохимической кинетики и достаточно точно описывается уравнением Тафеля.
Уравнение Тафеля для случая катодной реакции имеет вид
$$ \eta_{H} = a_{a} + b_{a} \cdot lgi_{k} \ , $$
где
ηн – перенапряжение водорода, равное ∆Ек = Ек – Ер;
Ек – потенциал электрода при протекании катодного тока iк;
Ер – равновесный потенциал водородного электрода в данной коррозионной среде;
ак – постоянная, равная ηн при iк = 1 A/см2;
bк = ∂ηн / ∂ lg iк = ∂ Ек / ∂ lgiк – наклон тафелевого (линейного) участка поляризационной кривой.
Скорость коррозии определяется методом тафелевской экстраполяции
$$ \begin{matrix} \eta = a_{a} b_{a} \cdot lgi \ \eta = a_{k} + b_{k} \cdot lgi \end{matrix} $$
** Формула не работает**