1.5 Электрохимическая коррозия#
Электрохимическая коррозия – процесс разрушения металла в электропроводящей среде, при котором ионизация атомов металла и восстановление окислительного компонента среды протекают не в одном акте, и их скорости зависят от величины электродного потенциала металла.
Первопричиной коррозии металлов является их термодинамическая неустойчивость.
При взаимодействии с электролитами металлы самопроизвольно растворяются, переходя в более устойчивое окисленное ионное состояние.
При электрохимической коррозии имеет место перенос электрических зарядов. Коррозионный процесс возникает в результате работы короткозамкнутых гальванических элементов, образующихся вследствие неоднородности металла (структурной, из-за влияния примесей) или окружающей среды (различие в составе, температуре на поверхности раздела фаз и т.д.).
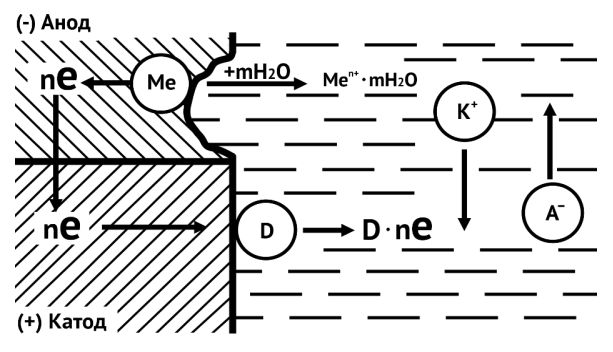
Реакция взаимодействия металла со средой в этом случае может быть разделена на самостоятельные процессы:
1. анодный (окислительный) процесс – переход металлических ионов в раствор с образованием гидратированных ионов и соответствующего количества избыточных электронов на поверхности металла:
$$ Me + mН_{2}O → Me^{n+}·mH_{2}O + nе $$
2. катодный (восстановительный) процесс – ассимиляция избыточных электронов ионами, атомами или молекулами электролита (деполяризаторами D), которые при этом восстанавливаются:
$$ ne + D → [D·ne]; $$
3. процесс движения электронов в металле от анодных участков к катодным и перемещение катионов и анионов в растворе.
Типы коррозионных элементов#
Все коррозионные элементы можно разделить на три группы:
- Элементы, состоящие из двух металлов, погруженных в растворы различных электролитов.
- Элементы, образованные при погружении электродов из одного и того же металла в растворы различных электролитов или в растворы одного электролита, различающиеся концентрацией, температурой, интенсивностью перемешивания.
- Элементы, образующиеся при погружении двух металлов в раствор одного и того же электролита.
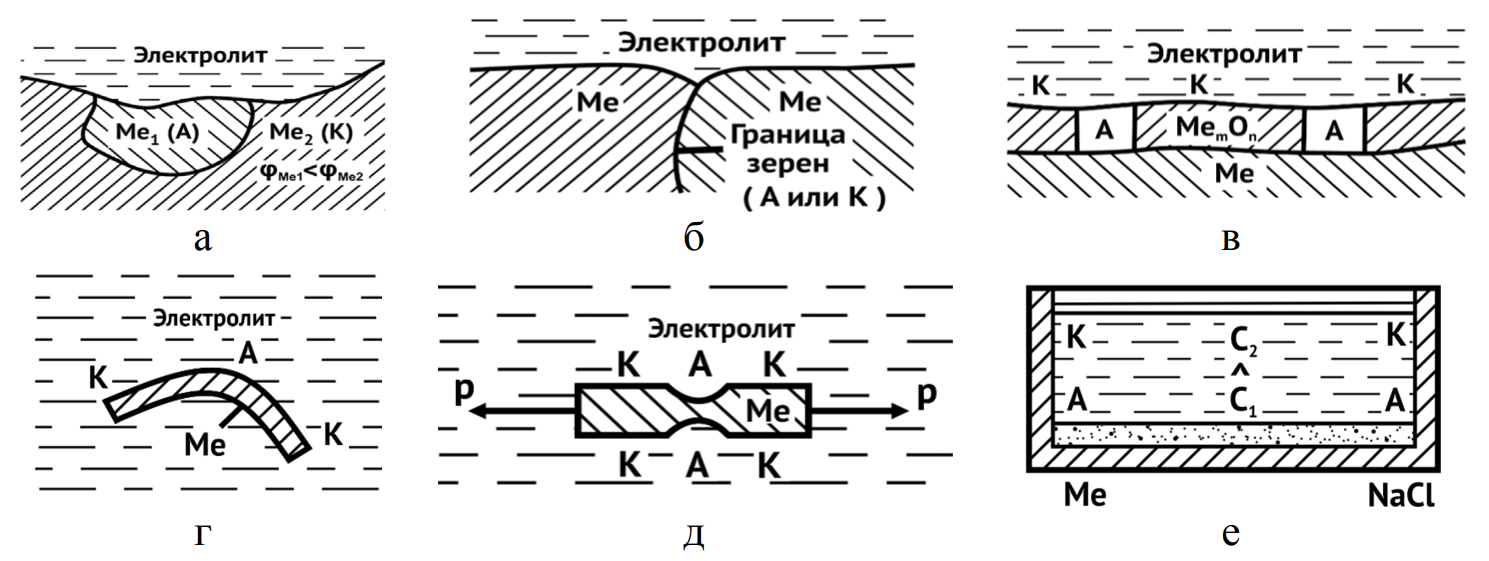
- а – включения с отличающимися электродными потенциалами;
- б – границы блоков мозаики и зерен (служат катодами или анодами);
- в – металл в порах защитных пленок (анод);
- г, д – концентраторы остаточных (г) и действующих (д) напряжений являются анодами;
- е – участки металла, соприкасающиеся с более концентрированными растворами солей с активными анионами (аноды)
На практике чаще всего приходится иметь дело с элементами третьего типа. Возникновение коррозионных элементов происходит не только при контакте разнородных металлов, но и при воздействии электролита на один и тот же металл, отличающийся на различных участках физической или химической неоднородностью.