1.6 Электродные потенциалы металлов. Электроды сравнения#
Между металлом и электролитом возникает разность потенциалов, называемая потенциалом металла. Для решения инженерных задач необходимо знать величины электродных потенциалов металлов.
Металлы сильно различаются по своей химической активности. О ней можно судить по ряду напряжений металлов, в котором они расположены в порядке уменьшения их восстановительной активности в водных растворах.
В этот ряд включен также водород. Активность металлов убывает слева направо. Металлы, расположенные в начале ряда (до цинка), вытесняют водород из воды. Металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Металлы, потенциалы которых положительнее потенциала водорода, слабо подвержены коррозии.
С химической точки зрения стойкость к коррозии определяется положением в ряду напряжения металлов. Однако на поверхности металла может образовываться слой, замедляющий процессы химического взаимодействия, а также пленки продуктов реакции. Поэтому различают практический и теоретический ряды напряжения металлов.
Теоретический ряд напряжения металлов
$$ Li → Rb → K → Ba → Sr → Ca → Na → Mg → Al → Mn → Cr → Zn → Fe → Cd → $$
$$ → Co → Ni → Sn → Pb → H → Sb → Bi → Cu → Hg → Ag → Pd → Pt → Au $$
В качестве электрода сравнения принят стандартный водородный электрод (при давлении водорода в 1 атм. и активности ионов водорода в растворе, равной 1). Такой активностью обладает 1,3 н.-раствор соляной кислоты. Стандартный электрод представляет собой платиновую пластину, покрытую свежеосажденной мелкодисперсной платиной, способной поглощать большие количества водорода, погруженную в вышеуказанный раствор и насыщенную водородом при р = 1атм. Возникающий потенциал принят условно за 0.
Потенциалы металлов, расположенные в порядке от наименьших значений до наибольших, образуют нормальный ряд напряжений металлов:
| Реакция | Потенциал, B | Реакция | Потенциал, B |
|---|---|---|---|
| Mg2+ + 2e = Mg | -2,37 | Sn2+ + 2e = Sn | -0,136 |
| А13+ + 3е = Аl | -1,66 | Pb2+ + 2e = Pb | -0,126 |
| Ti2+ + 2e = Ti | -1,63 | Fe3+ + 3e = Fe | -0,037 |
| Zr4+ + 4e = Zr | -1,53 | Sn4+ + 4e = Sn | +0,007 |
| Ti3+ + 3e = Ti | -1,21 | Sb4+ + 4e = Sb | +0,24 |
| Cr2+ + 2e = Cr | -0,913 | Cu2+ + 2e = Cu | +0,337 |
| Zn2+ + 2e = Zn | -0,762 | Cu+ + e = Cu | +0,521 |
| Cr3+ + 3e = Cr | -0,74 | Pb4+ + 4e = Pb | +0,784 |
| Fe2+ + 2e = Fe | -0,44 | Ag+ + e = Ag | +0,799 |
| Cd2+ + 2e = Cd | -0,402 | Pd2+ + 2e = Pd | +0,987 |
| In3+ + 3e = In | -0,342 | Pt2+ + 2e = Pt | +1,19 |
| Ni2+ + 2e = Ni | -0,25 | Au2+ + 2e = Au | +1,68 |
Чем более электроотрицателен потенциал металла, тем больше возможность перехода его в ионное состояние. Электроотрицательные металлы вытесняют в электрохимических реакциях более электроположительные металлы (рисунок 5).
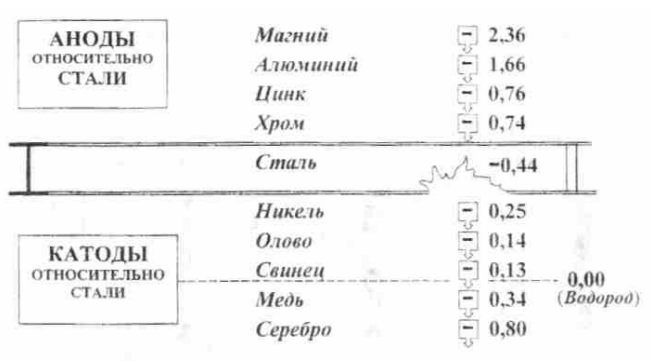
Электродный потенциал металла может быть измерен только относительно дополнительного электрода, образующего гальванопару с исследуемым металлом. Этот электрод называется электродом сравнения. При указании величины потенциала обязательно указывается вид электрода сравнения (кроме водородного электрода).
Электроды сравнения подразделяют на следующие группы: газовые, первого и второго рода.
Газовые электроды измеряют потенциал окислительно восстановительной реакции газа в водных растворах.
В газовых электродах сравнения благородный металл (Pt) помещается в насыщенный газом электролит. Причем металл не должен вступать в химическое взаимодействие с этим электролитом. Для научных исследований применяют насыщенный водородный электрод сравнения (рисунок 6).
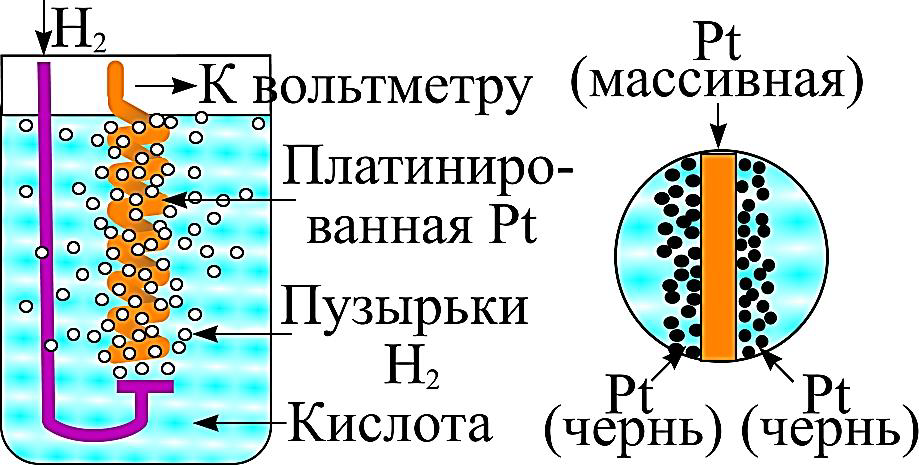
Стандартный электрод представляет собой проволоку или пластину из платинированной платины, помещенную в насыщенную водородом (p = 0,1 МПа) сильную неорганическую кислоту (HCl, H2SO4). Потенциал, измеренный относительно насыщенного водородного электрода сравнения, обозначается НВЭ.
Измерение потенциала с помощью водородного электрода сравнения проводят с помощью солевого мостика (рисунок 7).
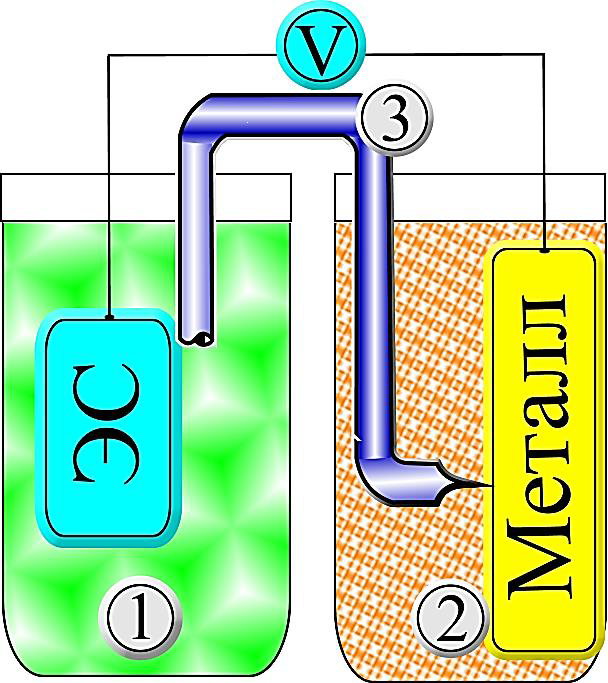
- 1 – электролит электрода сравнения (ЭС);
- 2 – рабочий электролит, в который помещается исследуемый металл;
- 3 – солевой мостик
В практике коррозионных исследований наибольшее распространение получили электроды сравнения первого и второго рода.
Электроды сравнения первого рода используют скачок потенциала «металл – электролит» ΔφМе - Эл = φМе – φЭл.
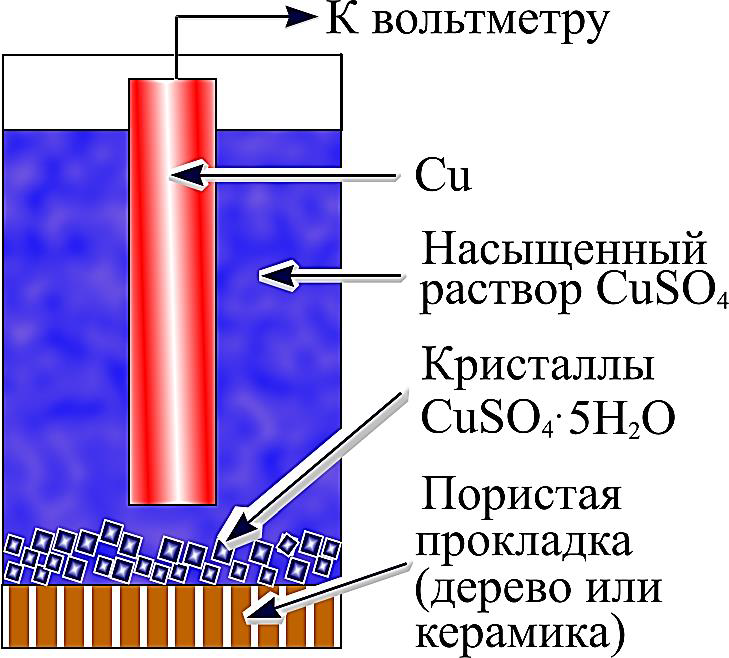
В коррозионной практике чаще всего используют медно-сульфатный электрод сравнения Cu│CuSO4 (рисунок 8). Он состоит из диэлектрического корпуса, заполненного насыщенным раствором медного купороса, в который помещается медный стержень или пластина. На практике для поддержания насыщенности раствора в него добавляются кристаллы медного купороса. Медно-сульфатный электрод сравнения обозначается МСЭ (м.с.э., Cu/CuSO4). Достоинство этого электрода сравнения – низкое внутреннее сопротивление и простота конструкции. Однако недостаточная стабильность не позволяет использовать его в лабораторных коррозионных исследованиях.
Для электролитического контакта электрода с грунтом служат пористые прокладки (мембраны, дерево, пористая керамика). В ряде случаев корпус электрода сравнения целиком изготавливают из пористой керамики. При этом верхнюю часть корпуса покрывают водонепроницаемой глазурью.
Электроды сравнения второго рода используют скачок потенциала «металл – электролит». Электроды сравнения электролитически соединяются с исследуемым объектом с помощью пористой прокладки, мембраны, асбестового фитиля, солевого мостика или напрямую.
Пример измерения потенциала с помощью медно-сульфатного электрода сравнения приведен на рисунке 9.
В лабораторной практике наибольшее применение нашли хлорсеребряный и каломельный электроды сравнения (рисунок 10).
Хлорсеребряный электрод представляет собой серебряную пластинку, покрытую слоем хлорида серебра и опущенную в раствор хлорида калия. Хлорсеребряные электроды сравнения обозначаются ХСЭ (х.с.э., Ag/AgCl).
Каломельный электрод представляет собой ртутный электрод, помещенный в насыщенный раствор Hg2Cl2 (каломель) и раствор KCl.
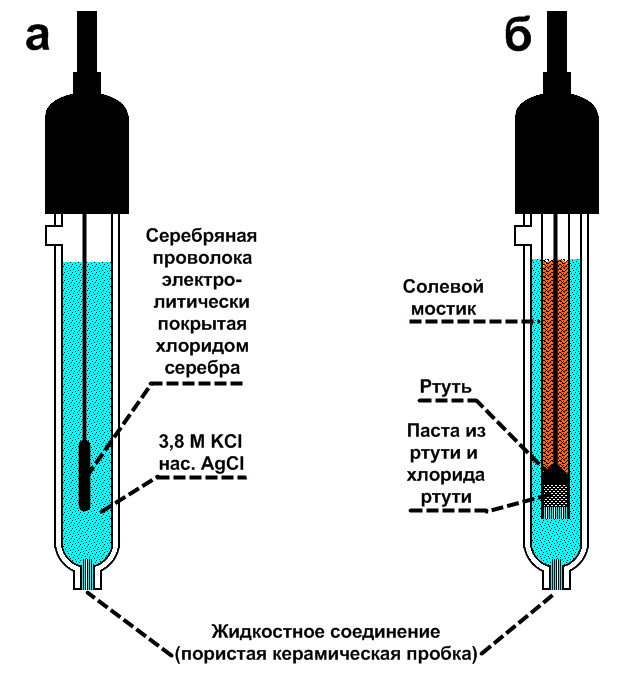
- а – хлорсеребряный электрод;
- б – каломельный электрод